Cholesterin und Herzgesundheit 2026: Der aktuelle Stand in der Longevity-Medizin
Der Cholesterinstoffwechsel und seine Rolle in der kardiovaskulären Gesundheit unterliegen derzeit einer wissenschaftlichen Neuinterpretation. Während Cholesterin lange Zeit als primär schädlich galt, zeigt sich ein komplexeres Bild: Es geht weniger um das Cholesterin selbst als vielmehr um die Transportpartikel, die es im Blut befördern. Lipoprotein(a) und Apolipoprotein B erweisen sich als kritischere Marker als klassische LDL-Messungen, doch werden sie im Routinebluttest nicht standardmäßig erfasst. Die Lipidsenkerforschung hat 2025 bedeutende Durchbrüche erzielt mit oralen PCSK9-Hemmern und anderen Wirkstoffen, die eine kardiovaskuläre Prävention neu definieren. Gleichzeitig verdeutlichen genetische Studien, dass Ernährungsumstellungen bei manchen Menschen nur begrenzt wirken. Hormonelle Faktoren prägen das Profil erheblich, und die Absenkung von Cholesterin-Zielwerten in den vergangenen Jahrzehnten wird zunehmend kritisch hinterfragt. Für die Langlebigkeit ergibt sich ein paradoxes Bild: Während die Kontrolle kardiovaskulärer Risiken zentral für ein langes Leben ist, zeigen Extremsenkungen der Cholesterinwerte möglicherweise unerwünschte Effekte.
Inhaltsverzeichnis
ToggleDie vermeintlichen Schädiger: Warum Lipoprotein(a) und Apolipoprotein B unterschätzt werden
Das Dogma der Cholesterinmessung zeigt tiefe Risse. Das Problem liegt nicht primär im Cholesterin-Molekül selbst, sondern in der Anzahl und Zusammensetzung der Lipoproteinpartikel, die es transportieren. Ein Mensch kann einen identischen LDL-Cholesterin-Wert aufweisen wie eine andere Person, doch vollkommen unterschiedliche Mengen dieser atherogenen Partikel im Blut haben – und damit ein völlig unterschiedliches Herzinfarktrisiko tragen.
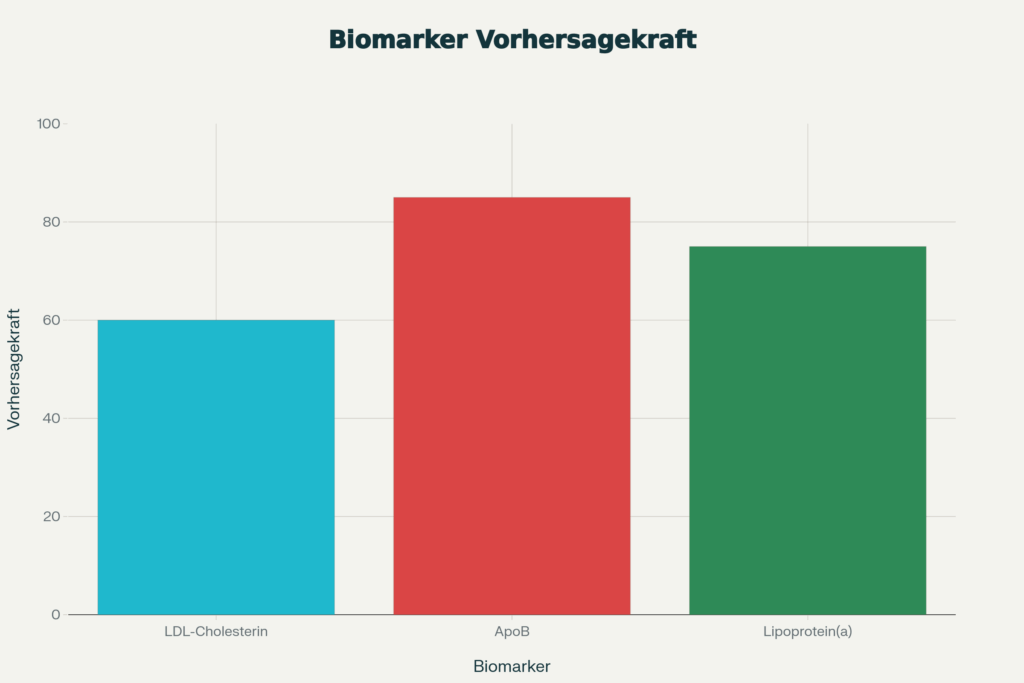
Lipoprotein(a), abgekürzt Lp(a), stellt einen unabhängigen Risikofaktor dar, der von anderen Lipidmarkern entkoppelt ist. Dieses Lipoprotein trägt nicht nur Cholesterin, sondern auch Apolipoprotein(a), das eine entzündungsfördernde und atherosklerotische Wirkung ausübt. Epidemiologische Studien wie die Copenhagen City Heart Study mit fast 24.000 Teilnehmern zeigen einen klaren statistischen Zusammenhang zwischen erhöhtem Lp(a) und vorzeitigen kardiovaskulären Erkrankungen. Das Risiko für Herzinfarkt, Schlaganfall und selbst für degenerative Herzklappenerkrankungen steigt mit jedem Anstieg des Lp(a)-Spiegels linear an.
Apolipoprotein B (ApoB) ist das zentrale Strukturprotein aller atherogenen Lipoproteine – LDL, VLDL, IDL und auch Lp(a). Jedes dieser schädlichen Partikel trägt exakt ein ApoB-Molekül. Deshalb ist die ApoB-Konzentration im Blut das präziseste Maß für die Anzahl atherosklerotischer Partikel überhaupt. Schwedische und amerikanische Studien, zuletzt beim AHA-Kongress 2025 präsentiert, bestätigen übereinstimmend: ApoB sagt Herzinfarkte zuverlässiger voraus als das klassische LDL-Cholesterin. Zwei Menschen mit gleichem LDL-Cholesterin-Spiegel können unterschiedliche ApoB-Werte und damit fundamental unterschiedliche Risiken aufweisen.
Dennoch ist die Lp(a)-Messung nicht Teil des Standard-Lipidscreenings und wird von vielen Kliniken nicht routinemäßig durchgeführt. Die Europäische Gesellschaft für Kardiologie empfiehlt zwar eine einmalige Lp(a)-Bestimmung bei bestimmten Risikogruppen – etwa Patienten mit frühzeitiger Atherosklerose, familiärer Hypercholesterinämie oder Aortenklappenstenose –, doch diese Empfehlung ist nicht obligatorisch. ApoB wird zwar technisch gemessen, bleibt aber außerhalb von spezialisierten Lipidkliniken ein exotischer Parameter. Der tiefere Grund liegt in der trägen Routine von Bluttestkonventionen und vermutlich auch ökonomischen Interessen: Bestehende LDL-Cholesterin-Tests sind etabliert, kostengünstig und verankert in den Köpfen von Ärzten und Patienten. Eine Lp(a)-Messung erfordert spezielle Laborverfahren, und ApoB-Bestimmungen sind nicht in allen Laboren verfügbar. Für die Industrie bedeutet die Fokussierung auf LDL-Cholesterin eine klare therapeutische Zielgröße; komplexere Parameter wie ApoB oder Partikelzahl erlauben weniger eindeutige Interventionsschwellen. Der Paradigmenwechsel hin zu ApoB und Lp(a) als primären Risikobiomarkern steht noch bevor, zumal die wissenschaftliche Evidenz dafür wächst.
Der therapeutische Sprung 2026: Neue Lipidsenker ändern die Prävention
Die Lipidsenkerforschung erlebt einen Umbruch. Nach Jahrzehnten der Statin-Dominanz eröffnen sich neue Wege. Die zweite und dritte Generation von Lipidsenkern wird in diesem Jahr zur Realität für breitere Patientengruppen. Der orale PCSK9-Hemmer Enlicitide wurde beim AHA Congress 2025 als bahnbrechend präsentiert. Dies ist das erste oral einzunehmende PCSK9-Inhibitor-Präparat, das LDL-Cholesterin in einem Ausmaß senkt, das bisher nur mit injizierbaren Antikörpern möglich war. PCSK9-Hemmer wirken, indem sie ein Schlüsselprotein neutralisieren, das LDL-Rezeptoren auf der Leberoberfläche zum Abbau führt; durch dessen Inhibition bleiben diese Rezeptoren funktionsfähig und transportieren mehr LDL aus dem Blut. Großangelegte Studien wie FOURIER und ODYSSEY OUTCOMES zeigen, dass PCSK9-Antikörper nicht nur LDL um bis zu 75 Prozent senken, sondern auch die Rate an Herzinfarkten, Schlaganfällen und kardiovaskulären Todesfällen signifikant reduzieren. Enlicitide als orale Formulierung könnte die Akzeptanz und Compliance revolutionieren, da Patienten von wiederholten Injektionen befreit werden.
Der orale PCSK9-Hemmer AZD0780 wurde beim ACC-Kongress 2025 in der PURSUIT-Studie vorgestellt und zeigte Wirksamkeits- und Verträglichkeitsprofile, die typisch für diese Wirkstoffklasse sind. Inclisiran, eine kleine interferierende RNA (siRNA), verkörpert einen anderen Ansatz. Sie wird zweimal jährlich injiziert und unterdrückt die mRNA-Translation des PCSK9-Proteins in der Leber direkt. In den ORION-Studien senkte Inclisiran LDL um 50 Prozent mit stabiler, über Monate anhaltender Wirkung. Eine Endpointstudie für kardiovaskuläre Ereignisse wird erwartet. Bempedoinsäure (ACL-Hemmer) wurde 2020 in der EU zugelassen und inhibiert die ATP-Citrat-Lyase, ein Enzym der hepatischen Cholesterinbiosynthese. Sie senkt LDL-Cholesterin in Monotherapie um etwa 25 Prozent, in Kombination mit Statinen um zusätzlich 15-24 Prozent, und mit Ezetimib sogar um etwa 48 Prozent. Ein großer Vorteil: Im Gegensatz zu Statinen verursacht Bempedoinsäure keine Myalgien. Allerdings wurde eine erhöhte Harnsäure und ein Gichtrisiko bei manchen Patienten beobachtet. Evinacumab, ein ANGPTL3-Inhibitor, funktioniert komplett unabhängig vom LDL-Rezeptor und senkt LDL massiv, auch bei Patienten mit homozygoter familiärer Hypercholesterinämie. Dies ist eine Therapie für Patienten, bei denen konventionelle Mechanismen versagen.
Das wachsende Arsenal zeigt, dass 2026 nicht mehr nur eine Statin-Monokultur existiert. Kombinationstherapien werden Standard: Statine, Ezetimib, PCSK9-Hemmer, Inclisiran und Bempedoinsäure sind Realität für Hochrisikopatienten. Die Strategie verschiebt sich von „so niedrig wie möglich“ zu einer individualisierten Therapie, basierend auf Risiko, Genetik und Verfügbarkeit.
Das Ernährungsparadoxon: Warum Gene die Oberhand gewinnen
Einer der hartnäckigsten Mythen der Präventionsmedizin ist, dass eine Umstellung der Ernährung die Cholesterinwerte bei jedem Menschen deutlich senken kann. Die Realität ist deutlich nuancierter und genetisch determiniert. Bei den meisten Menschen mit genetisch normalem Cholesterinmetabolismus funktioniert ein hochsensibler Feedback-Mechanismus: Wenn die Cholesterinaufnahme aus der Nahrung steigt, drosselt die Leber die Eigenproduktion – und umgekehrt. Dies ist der Grund, warum die klassische Warnung vor Eiern und Butter für durchschnittliche Menschen nur begrenzte Wirkung zeigt. Kohortenstudien wie Framingham und PURE belegen, dass Nahrungscholesterin bei den meisten Menschen nur einen geringen Einfluss auf den Serumcholesterinspiegel hat. Allerdings gibt es eine Minderheit – die Hyperresponder – bei denen diese Regulationsfähigkeit stark eingeschränkt ist. Bei ihnen führt eine cholesterinreiche Ernährung tatsächlich zu erheblichen Blutspiegelerhöhungen. Diese genetische Variabilität erklärt, warum zwei Menschen mit identischer Ernährungsintervention vollkommen unterschiedliche Reaktionen zeigen.
Die Fettsäurezusammensetzung der Nahrung ist übrigens bedeutsamer als die bloße Gesamtfettzufuhr. Besonders interessant: Der Konsum von Zucker und raffinierten Kohlenhydraten scheint das Lipoprotein-Partikelprofil stärker zu modulieren als gesättigte Fettsäuren. Lösliche Ballaststoffe wie β-Glucane können durch Bindung von Gallensäuren LDL um bis zu 10 Prozent senken. Die bedeutsamste genetische Variation existiert bei der familiären Hypercholesterinämie (FH). Diese vererbte Erkrankung tritt mit einer Häufigkeit von etwa 1:500 auf und ist oft unterdiagnostiziert. Die Ursachen sind Mutationen in den Genen. Menschen mit heterozygoten FH-Mutationen (ein mutiertes Gen) können sich pflanzenbasiert und fettarm ernähren – es nützt wenig. Ihr Cholesterin wird sich im Blutkreislauf ansammeln, egal welche Lebensstiländerungen sie vornehmen.
Der klinische Durchbruch bei FH-Mutationen war die Erkenntnis, dass die Betroffenen nicht an ihrem Cholesterin schuld sind. Ihre genetische Unfähigkeit, LDL-Rezeptoren adäquat zu exprimieren, macht Ernährungsinterventionen zu einer Sisyphus-Aufgabe. Diese Patienten sind auf Medikamente angewiesen – und reagieren oft gut darauf. Menschen mit heterozygoter FH und nur einem mutierten Gen haben ohne Therapie ein etwa 8-fach erhöhtes Risiko für kardiovaskuläre Erkrankungen im Vergleich zur Allgemeinbevölkerung. Für Patienten bedeutet dies eine fundamentale Botschaft: Während Lebensstiländerung für Menschen ohne genetische Prädisposition wertvoll ist, wird ihre Wirkung bei genetisch determinierter Hypercholesterinämie überschätzt. Die frühe genetische Diagnostik – insbesondere das Kaskadenscreening in Familien mit FH – ist deshalb zentral. Kinder von FH-Patienten sollten frühzeitig identifiziert werden.
Der hormonelle Orchestrator: Warum Hormone das Lipidprofil regieren
Hormonale Zustände und Veränderungen prägen das Cholesterin-Blutprofil fundamental. Dies ist besonders evident bei Frauen. Die Schilddrüse steuert über ihre Hormone T3 und T4 zahlreiche Stoffwechselvorgänge, einschließlich des Fettstoffwechsels. Bei einer Hypothyreose (Schilddrüsenunterfunktion) wird weniger Fett aus dem Blut in die Leber transportiert. Die Folge: LDL-Cholesterin und Triglyzeride steigen an. Eine Hyperthyreose (Schilddrüsenüberfunktion) führt zum gegenteiligen Effekt – die Cholesterinwerte sinken. Ärzte und Kliniken sollten bei persistierend erhöhten Cholesterinwerten immer auch die Schilddrüsenfunktion überprüfen; eine unbehandelte Hypothyreose wird die beste Lipidsenkertherapie torpedieren.
Östrogene haben eine profunde Wirkung auf den Lipidstoffwechsel. Östrogene geben der Leber den Befehl, ihre „Cholesterin-Staubsauger“ (LDL-Rezeptoren) an der Oberfläche zu aktivieren. Diese Sauger fischen das schlechte LDL-Cholesterin effektiver aus dem Blut. Gleichzeitig erhöht Östrogen das HDL-Cholesterin, insbesondere die HDL-2-Fraktion. Die Konzentration von LDL-Cholesterin und Gesamtcholesterin sinkt unter Östrogengabe um etwa 10–20 Prozent. Dieser Vorteil erklärt teilweise, warum Frauen vor der Menopause ein niedrigeres kardiovaskuläres Risiko haben als altersgleiche Männer. In den Wechseljahren ändert sich das Bild dramatisch. Mit dem Östrogenmangel in der Postmenopause kommt es zu ungünstigen Verschiebungen: Gesamtcholesterin und LDL-Cholesterin steigen, HDL sinkt, und die Triglyzeride erhöhen sich. Eine aktuelle Studie zeigte, dass die hormonellen Veränderungen der Menopause 85 Metaboliten (chemische Zwischen- und Endprodukte des gesamten Stoffwechsels) im Blut signifikant verschoben – mit permanentem Anstieg des LDL- und der Triglyceride. Die Veränderungen sind proportional zur Dauer des Östrogenmangels. Interessanterweise deutet die gleiche Studie darauf hin, dass ein frühzeitiger Start einer Hormonersatztherapie in der Menopause den größten kardioprotektiven Effekt bietet.
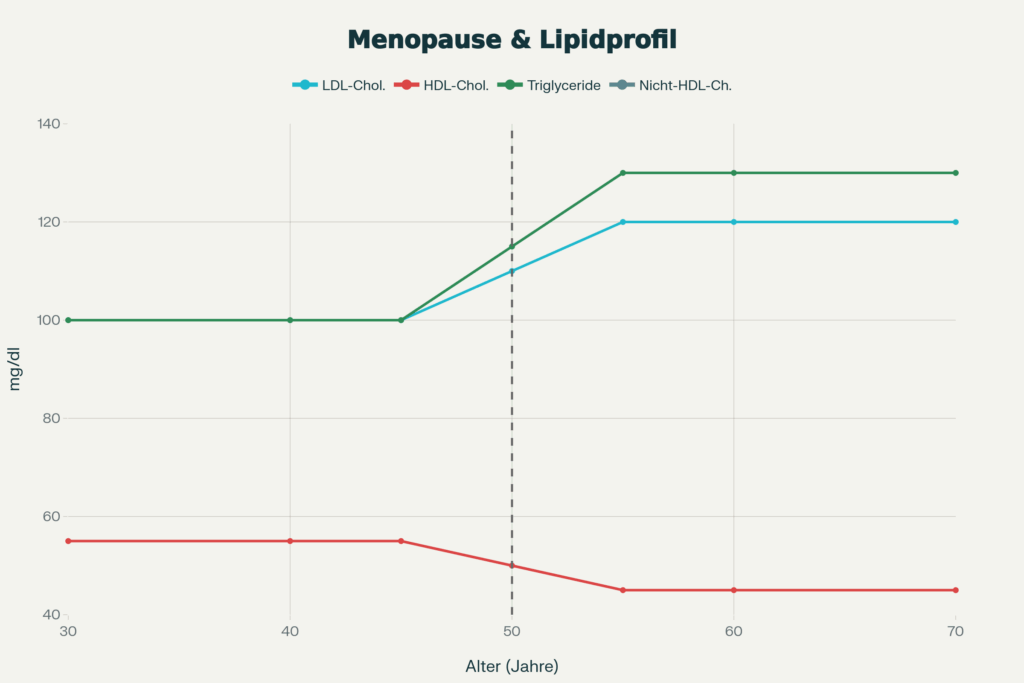
Die Art der Hormontherapie spielt eine Rolle. Orale Östrogentherapie führt zu einem stärkeren Anstieg der Triglyzeride, und die entstehenden LDL-Partikel werden kleiner und dichter. Auf der Haut angewendetes Östradiol zeigte vorteilhaftere Effekte auf das Lipidprofil. Die Wahl des Gestagens beeinflusst auch das HDL: Synthetische Gestagene wie MPA oder Norgestrel senken HDL stärker ab als mikronisiertes Progesteron. Kurzum: Eine 45-jährige Patientin in Prämenopause benötigt möglicherweise fünf Jahre später in der Postmenopause eine vollkommen andere Lipidsenkerstrategie. Und bei Patienten unter Hormonersatztherapie ist regelmäßiges Lipid-Monitoring essenziell, um Dosierungen anzupassen.
Die Zielwert-Senkung: Wie Grenzwerte kontinuierlich nach unten verschoben wurden
Eine der kontrovers diskutierten Entwicklungen der modernen Medizin ist die kontinuierliche Absenkung von Cholesterin-Zielwerten über die letzten 25 Jahre. Was früher als normal galt, ist heute eine Indikation zur Therapie. In den 1980er Jahren galt ein Gesamtcholesterin von deutlich über 260 mg/dl als behandlungsbedürftig. 1990 setzte die ATP III-Leitlinie die ersten risikoadaptierten LDL-Zielwerte fest. Ein Mensch ohne Risikofaktoren sollte ein LDL unter 160 mg/dl haben. Diese Grenzwerte schienen rational und basierten auf epidemiologischen Daten.
Dann, beginnend in den 2000er Jahren, geschah ein Paradigmenwechsel. Die Leitlinienverfasser argumentierten, dass, wenn ein statininduzierter LDL-Spiegel von 70 mg/dl gut sei, müssten 55 mg/dl noch besser sein und 40 mg/dl möglicherweise optimal. Das Leitmotiv klang so: „the lower the better“ oder „as low as possible“. Diese Logik ist aber, wie Kritiker bemerken, niemals in prospektiven randomisierten Studien getestet worden. Die europäischen ESC/EAS-Leitlinien von 2019 verschärften dies erheblich: Für Patienten mit sehr hohem kardiovaskulärem Risiko wird ein LDL-Ziel unter 55 mg/dl empfohlen, und für solche mit wiederholten Ereignissen trotz optimaler Therapie sogar unter 40 mg/dl. Zum Vergleich: Vor 20 Jahren wäre ein solcher Patient mit einem LDL von 70–80 mg/dl als „gut eingestellt“ betrachtet worden.

Die Folge dieser Zielwert-Senkung ist dramatisch: Die Task Force räumt ein, dass die Beweislage für die neuen Zielwerte „limitiert“ ist und es keine randomisierte kontrollierte Studie gibt, die prospektiv LDL-Senkung in diese Bereiche untersucht hat. Dennoch wird nun wahrscheinlich mehr als die Hälfte der erwachsenen Bevölkerung zum Behandlungsfall. Kritiker sagen, dass dies „Medikalisierung im großen Stil“ sei. Eine systematische Überprüfung analysierte 35 randomisierte, kontrollierte Studien, die die Leitlinienzielwerte testeten. Das überraschende Ergebnis: Von 13 Studien, die die empfohlenen Reduktionsziele (> 50 Prozent LDL-Senkung) erreichten, konnte in nur einer Studie ein positiver Einfluss auf die Gesamtmortalität nachgewiesen werden, in fünf Studien immerhin eine Reduktion kardiovaskulärer Ereignisse. Von 22 Studien, die die Ziele nicht erfüllten, wurden in vier Studien Verbesserungen der Mortalität beobachtet, in weiteren 14 Studien kardiovaskuläre Vorteile. Dies deutet darauf hin, dass die Erreichung extremer Zielwerte nicht automatisch zu besseren klinischen Ergebnissen führt.
Ein neuer Ansatz wird diskutiert: Statt sich rigide auf Zielwerte zu fixieren, könnte die Lipidsenkung auf Basis einer Risikoschätzung individualisiert werden. Die 2013 veröffentlichte AHA/ACC-Leitlinie ging diesen Weg und setzte strikte LDL-Zielwerte zugunsten einer risikogesteuerten Therapieintensität aus. Diese Flexibilität könnte rationaler sein als der „je niedriger, desto besser“-Ansatz. Dennoch bleibt ein Dilemma: Es gibt unwiderlegbare Evidenz, dass moderat erhöhtes LDL-Cholesterin das kardiovaskuläre Risiko erhöht. Patienten mit sehr hohen LDL-Ausgangswerten (> 160 mg/dl) profitieren tatsächlich von intensiver Senkung – etwa durch Risikoreduktionen um 28 Prozent bei der Mortalität. Aber bei Patienten mit bereits moderatem LDL (< 100 mg/dl) ist der Zusatznutzen einer weiteren Intensivierung unklar.
Die Langlebigkeitsperspektive: Cholesterin in der Anti-Aging-Medizin
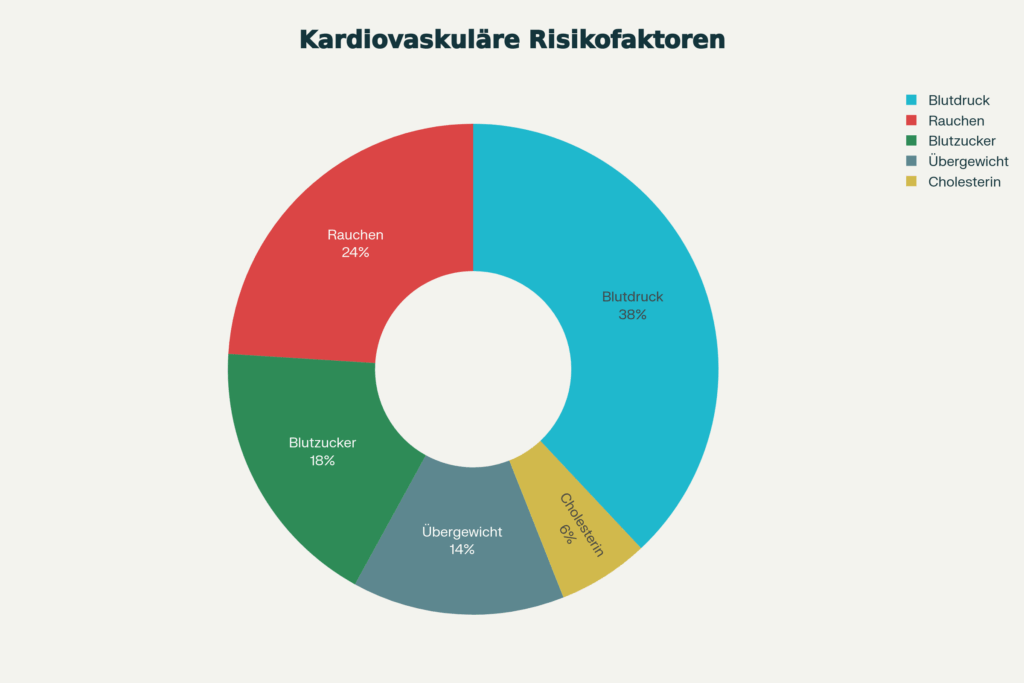
Für alle Menschen, die länger leben wollen, ist die Kontrolle kardiovaskulärer Risiken zentral – wobei Cholesterin nur eine Variable in einem komplexen System bleibt. Eine großangelegte internationale Analyse des „Multinational Cardiovascular Risk Consortium“ analysierte Daten von fast 400 000 Menschen. Das wurde bis zu 43 Jahre mit Follow-ups begleitet. Das zentrale Ergebnis: Das kardiovaskuläre Lebenszeitrisiko ist in jungen Jahren am höchsten und steigt am stärksten mit erhöhten non-HDL-Cholesterinwerten. Ein 45-jähriger Mann mit erhöhtem non-HDL-Cholesterin (3,7 bis <4,8 mmol/l) und zwei oder mehr zusätzlichen Risikofaktoren hat ein Langzeitrisiko von knapp 29 Prozent bis zum 75. Lebensjahr. Wenn sein non-HDL auf ein niedriges Niveau gesenkt würde, könnte dieses Risiko theoretisch auf etwa 6 Prozent fallen. Dies impliziert, dass frühe Prävention gewaltig sein könnte. Eine aktuelle Studie des UKE Hamburg mit etwa 120 Co-Autoren weltweit zeigte, dass Menschen, die im Alter von 50 Jahren keinen der fünf klassischen Risikofaktoren haben – kein Rauchen, normaler Blutdruck, kein Diabetes, kein Übergewicht, normale Cholesterinwerte – deutlich länger leben. Männer ohne diese Risikofaktoren leben im Schnitt gesamt 11,8 Jahre länger. Zudem 10,6 Jahre länger ohne Herz-Kreislauf-Erkrankungen als Männer mit allen fünf Risikofaktoren. Für Frauen sind die Zahlen noch beeindruckender: 14,5 zusätzliche Lebensjahre und 13,3 Jahre ohne Herzerkrankung. Dies zeigt: Cholesterin ist wichtig, aber nur einer von fünf Faktoren. Ein interessantes Paradoxon taucht in den Diskussionen immer wieder auf: Zu niedriges LDL-Cholesterin könnte mit erhöhtem hämorrhagischem Schlaganfall assoziiert sein. In einer Studie mit ca. 100 000 Chinesen hatten Teilnehmer mit LDL unter 70 mg/dl ein um 65 Prozent erhöhtes Risiko für intrazerebralen Schlaganfall, und bei LDL unter 50 mg/dl sogar um 169 Prozent. Dies ist ein wichtiges Warnsignal, dass es möglicherweise optimale Bereiche für LDL gibt, nicht nur obere Grenzen.
Für Longevity-Mediziner entsteht eine nuancierte Strategie: Frühe Identifikation und moderate Kontrolle erhöhter LDL-Werte in jungen Jahren (besonders bei genetischem Risiko) sind wahrscheinlich zentral für ein langes Leben. Die aggressive Senkung auf extreme Werte bei bereits älteren Menschen mit moderatem Risiko ist weniger klar justifiziert. Und die Berücksichtigung aller fünf Risikofaktoren – Blutdruck (mit dem größten isolierten Effekt auf Langlebigkeit), Rauchen, Gewicht, Blutzucker und Cholesterin – ist wahrscheinlich wichtiger als die Fixierung auf einen einzelnen Biomarker. Interessanterweise können kardiovaskuläre Risikofaktor-Interventionen möglicherweise längerfristige Anti-Aging-Effekte haben: Körperliche Aktivität, Omega-3-Fettsäuren und Lipidsenker können die Länge der Telomere – der Schutzkappen der Chromosomen – verlängern, was mit Lebenserwartung und Resistenz gegen Alterserkrankungen assoziiert ist. Dies deutet darauf hin, dass Cholesterinkontrolle ein Anti-Aging-Werkzeug sein könnte, nicht nur zur Prävention spezifischer Ereignisse.
2026 zeigt sich ein anderes Bild als die vereinfachten Dogmen früherer Jahre. Cholesterin ist wichtig, aber die Art des Transports (Lipoprotein-Partikeltyp und -zahl, gemessen via ApoB und Lp(a)) ist kritischer als die absolute Cholesterinmenge. Genetik bestimmt, wie Menschen auf Lebensstilinterventionen reagieren, und Faktoren wie Hormone prägen das Profil erheblich. Neue Medikamente bieten Optionen jenseits von Statinen. Die Zielwertbewegung der letzten Jahrzehnte wird zunehmend kritisch überprüft, und ein risikoadaptierter Ansatz ersetzt rigide Grenzen. Für ein langes, gesundes Leben bleibt kontrollierte kardiovaskuläre Prävention zentral – aber nicht durch Isolation eines Markers, sondern durch Integration aller Risiken und individuelle Optimierung.
-
Longevity Langlebige Früchte: Wie bestimmte Obstsorten zur gesunden Lebensverlängerung beitragen könntenIn der Forschung zur gesunden Lebensverlängerung rückt ein oft unterschätzter Faktor immer mehr in den Fokus: bestimmte Früchte....
-
Longevity Vollblutwäsche: Wie eine Blutfilterung Krankheiten bekämpfen und die Gesundheit optimieren könnteJeden Tag ist unser Körper Schadstoffen, Umweltgiften und entzündungsfördernden Molekülen ausgesetzt. Eine Methode, die gezielt solche problematischen Substanzen...
-
Longevity Die Hallmarks of Aging: Die biologischen Ursachen des Alterns und wie wir sie verlangsamen könnenDas Altern ist ein komplexer Prozess, der durch eine Vielzahl von biologischen Veränderungen auf zellulärer und molekularer Ebene...